生物相似度如何批准
生物相似点经历简化开发需求路径一号-3
Fresenius Kabi理解生物相似物的重要性并致力于有效安全处理病人生物类产品获批时,FDA和EMA要求它们通过一系列严格测试与参考产品的具体相似性必须在下列测试中显示:
分析研究证明Fresenius Kabi生物相似产品与核准产品相似分子和功能特征
临床研究清晰显示效率、安全性、药代物学和药代物学
生物相似开发1-3
显式分子与参考产品高度相似
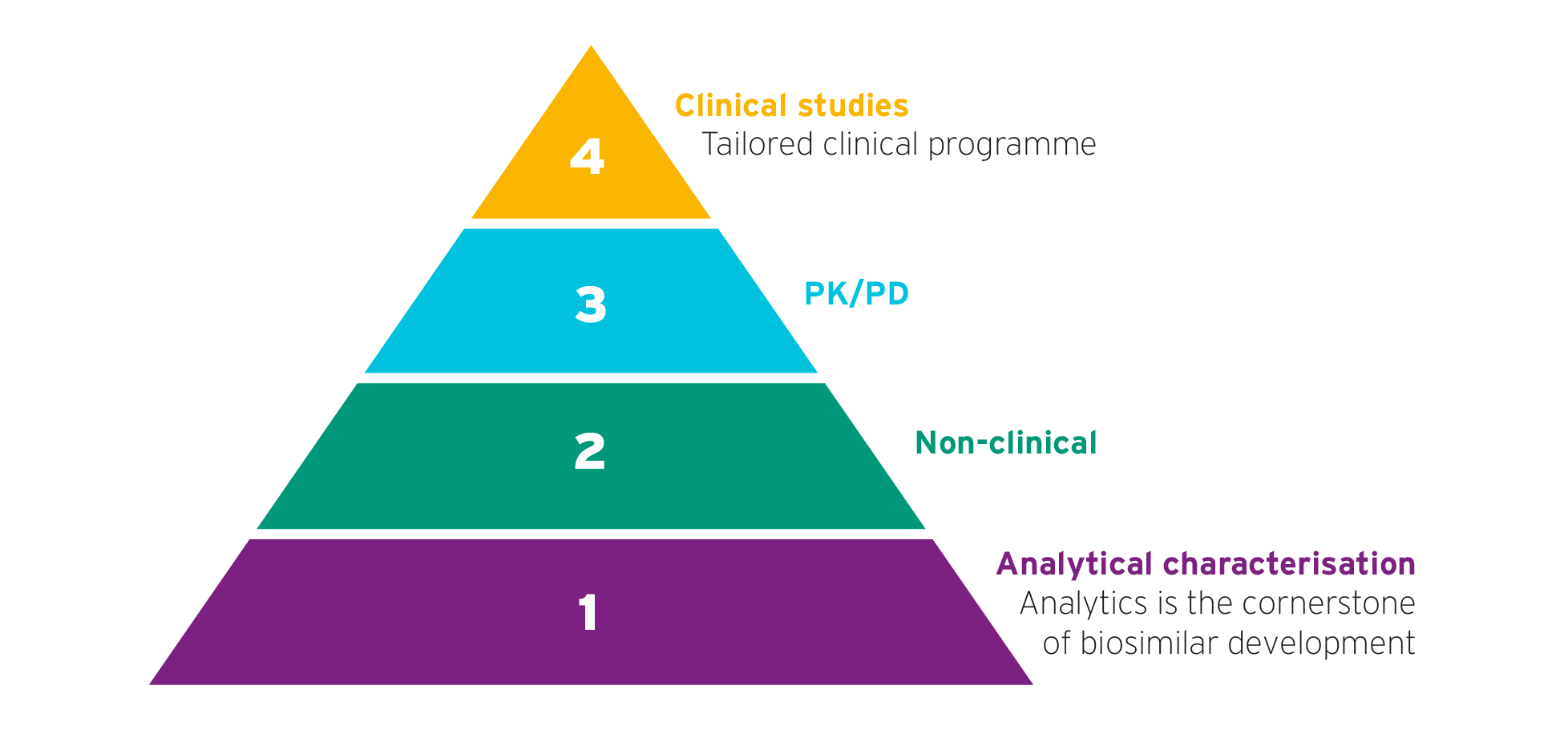
生物相似度强调初始开发阶段,并配有量身定制临床学习程序
生物相似点经历简化开发需求路径生物相似性证明与参考产品相似,则科学上有理由依赖某些现有参考产品安全性知识支持批准3
缩写开发需求路径允许生物相似性开发药程可能更快速和低费用3
10年临床经验显示 通过EMA认证的生物相似物 在所有经批准的标识中 安全有效使用一号EMA
所有经FDA批准的生物产品 包括参考产品和生物类产品 都接受严格评价3-FDA
EMA系统
欧盟2006年批准了首例生物类药在欧盟,生物学必须通过EMA通过他们的“集中程序”批准一号EMA/CHMP审查后产生“科学意见”,然后由欧盟委员会验证,欧盟委员会最终可授予全欧盟营销授权一号
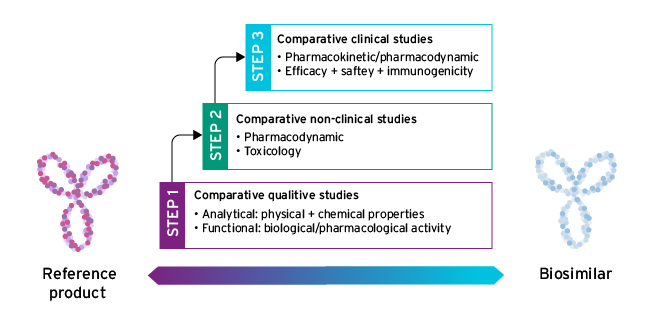
在EMA审批过程下,生物相似开发在很大程度上依赖“可比较性研究”,以建立与参考产品生物相似性包括头对头比较生物相似度和参考产品一号这项工作通过逐步进程实现,并适合每种产品:初始质量比较研究知识(步骤1)用于确定下一步开发所需非临床研究的程度和类型(步骤2)和临床研究(步骤3),目的是消除拟生物相似性与参考产品性能差异一号
三大关键步骤支持欧盟相似生物开发一号
美国林业局
通过2009年生物物价竞争和创新法,美国国会为生物学创建了简通通路,证明生物学与林业局已经核准的生物学相似或互换4简便通路的创建是为了向病人提供更多治疗选项,增加救生药的使用量并有可能降低医疗费用4
申请批准生物相似或互换产品时,必须包括显示与参考产品生物相似性的数据通常包括数据来源
- 分析研究:证明生物学与参考产品高度相似,尽管临床不活动组件有微小差异3
- 动物研究,包括毒性评估3
- 临床研究(或研究)显示推荐生物相似产品安全性、纯度和强度,并用参考产品许可的一个或多个标识显示通常包括评估免疫性、药代动力学和在某些情况下药代动力学,还可能包括比较临床研究3
除上述外,可互换产品应用中还必须包括信息或数据证明:
- 拟互换产品预期产生与任何病人参考产品相同的临床结果3
- 产品不止一次对病人管理,拟互换产品与参考产品互换不会增加安全风险或降低效果,比起使用参考产品而无需产品互换3
概念推理57
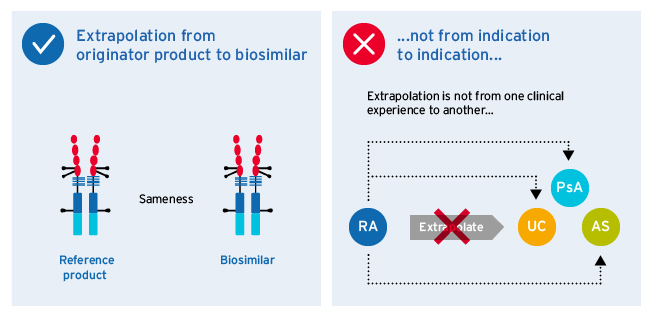
外推法指根据事先临床评价并批准指针参考产品,批准生物相似表示临床试验未评价该表示法57级
- 分析可比性确认产品物理化学特性高度相似
- 产品后发给一定数目的病人校验显示高度相似的临床行为
- 显示后,高度相似产品可推广到其他病人
外推法通过减少临床试验数开发出生物相似性5加速开发时间线并给予病人更多治疗选择
外推生物相似物标识5-7
为何选择生物相似物现在和将来学习这里
参考文献和注解
EMA欧洲药品局FDA食品药管局
开工欧药局生物类比欧盟:保健专业人员信息指南2017年可用地址 :
http://www.ema.europa.eu/docs/en_GB/document_library/Leaflet/2017/05/WC500226648.pdf (Accessed February 2019).二叉mcamishMWoollettG林药厂2012年91:405-4173级美国食品药管局-生物类2018年Available at: https://www.fda.gov/drugs/developmentapprovalprocess/howdrugsaredevelopedandapproved/approvalapplications/therapeutic
biologicapplications/biosimilars/default.htm (Accessed February 2019).4级美国食品药管局生物相似性2018年Available at: https://www.fda.gov/drugs/developmentapprovalprocess/howdrugsaredevelopedandapproved/approvalapplications/therapeutic
biologicapplications/biosimilars/default.htm (Accessed February 2019).5级门斯特德Het al.安翁科尔2008年411-4196级微信Met al.血迹2012年120:5111-51177欧药局含有单克隆抗体的类似生物药产品指南非临床问题(EMA/CHMP/BMWP/403543/2010)。2012年Available at: http://www.ema.Europa.eu/docs/en_GB/document_library/Scientific_guideline/2012/06/WC500128686.pdf (Accessed February 2019).
