生物相似度如何开发
生物相似开发需要训练有素的科学家
Fresenius Kabi拥有高质量药品开发的长期遗产我们拥有制造和生物技术方面的必要全球专门知识,目标是实现与参考生物处理高度相似性受产品质量优异驱动,Fresenius Kabi生物相似性在欧洲制造,符合法定GMP指南
相似生物开发需要深入理解参考产品一号这需要分析和描述引用产品识别关键特征2
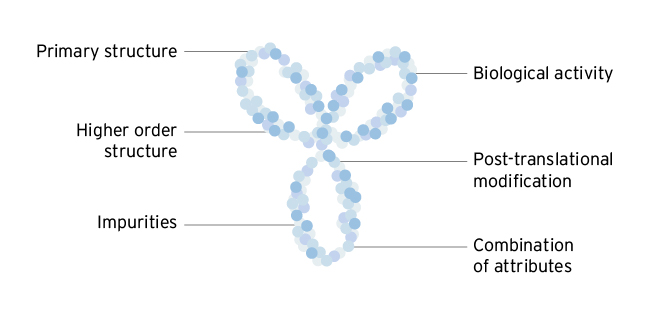
生物相似初级氨基酸序列完全由生物工程设计,而生物蛋白结构的其他特征,如三维折叠、晶化、电荷和杂质存在视制造过程而定可变性3生物特征可同时影响一种药物的抗原绑定性与免疫性,并因此可影响药效安全3约40种不同的分析方法用于评估约100种不同药特征,以了解生物类候选物与参考产品之间的生物相似性3分析研究是批准生物相似物过程的关键3
生物相似性匹配相关结构特征参考产品4
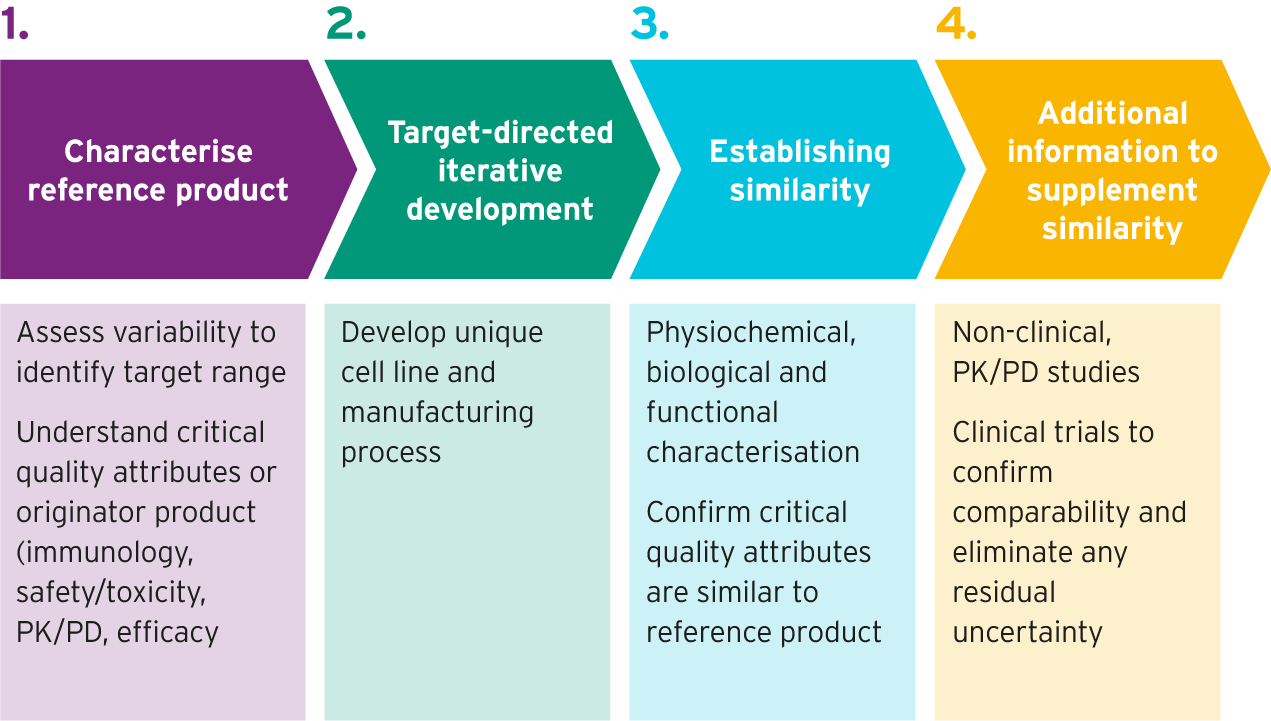
参考产品特征分析后,活细胞应用开发生物相似对象高素质科学家执行以下步骤实现这一点:
- 插入基因指令克隆5
- 生物学的不同版本制作后,每个版本由不同的细胞制作后,进行筛选以确定产生蛋白质的细胞线最相似参考生物学5
- 开发出制造生物相似性过程,以最大限度地实现生物相似性与参考产品之间的相似性5,6
生物相似开发过程七八
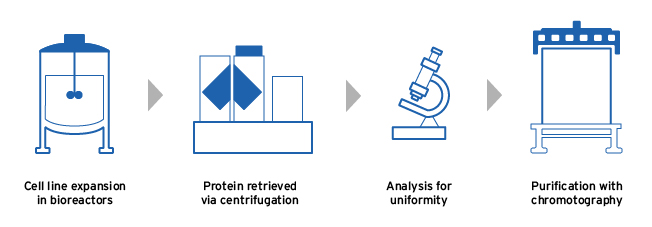
Fresenius Kabi使用下列步骤制造生物相似物,以便生产高质量最终产品:
- 所选细胞线在大型生物反应器中扩展,条件优化生成蛋白5,6
- 采集蛋白分析3D结构一致性和功用后再净化5
- 合成生物素养分离净化 消除任何不必要的杂质5,6
生物相似制造过程5,6
开发系统开发后,可进行实验性非临床研究,比较生物类与参考产品
生物相似度如何批准学习这里
参考文献和注解
GMP良好制造实践
开工欧药局2017年欧盟生物相似性保健专业人员信息指南Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Leaflet/2017/05/WC500226648.pdf (accessed in December 2020).二叉美国食品药管局 — — 证明治疗性蛋白产品与参考产品生物相似性的质量考量2015年网站https://www.fda.gov/downloads/drugs/guidets/ucm291134.pdf3级布洛维特Aet al.布列特J德马托2016年174:282-2864级美联储食品药品管理局行业Q6B规范指南:测试程序及生物技术/生物产品验收标准1999年Available at: http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm073488.pdf (accessed in December 2020) 5.古普塔SKet al.生物相似开发中的机遇与挑战2017年Available at: http://www.bioprocessintl.com/manufacturing/biosimilars/opportunities-challenges-biosimilar-development/ (accessed in December 2020).6级萨巴赫et al.Sem ArthRheum2016年S11-S187mcamishMWoollettG林药厂2013年93:315-317八点八分德摩拉FBRJClin药厂2015年80:949-956
